对于与患者直接或间接接触的器械,应当进行生物学评价。总的来说,生物学评价是一种风险管理活动,企业自产品设计开发时就应考虑其生物学风险,并在注册申报时提交生物学评价资料。那么企业应如何选择生物相容性检验项目呢?本期文章我们从生物相容性的定义及医疗器械使用情况分类来一一分析。
医疗器械的生物相容性是指器械在宿主的特定环境和部位与宿主直接或间接接触时所产生的相互反应的能力。或可理解为器械在生物体内处于静态或动态变化过程中,能耐受宿主各系统作用而保持相对稳定、不被排斥和破坏的生物学性能。“生物相容”与“生物不相容”并非某种材料的天然或绝对“标签”,生物相容性是动态概念,需结合材料具体性能和特定的临床应用场景进行判断。
1. 按人体接触性质,需要生物相容性信息的医疗器械分为三种:表面接触医疗器械、外部接入医疗器械和植入医疗器械。
1.1 表面接触医疗器械
按表面接触医疗器械的接触性质,又分为三种情况。第一种情况是仅与完整皮肤接触的医疗器械,常见的医疗器械产品有压缩绷带、固定带、医用手套等;第二种情况是与完整黏膜接触的医疗器械,常见的产品有接触镜、导尿管、气管内插管、支气管镜、某些义齿等;第三种情况是与伤口或其他损伤体表面接触的医疗器械,常见的产品就是创可贴、用于溃疡的敷料或封闭敷贴等。
1.2 外部接入医疗器械
按外部接入医疗器械的性质,又分为三种情况。第一种情况是不与血路直接接触,但作为通路向血管系统输入液体的医疗器械或组件,常见的产品有输液器具、延长器、转移器和输血器具等;第二种情况是与组织、骨或牙髓/牙本质系统接触的医疗器械,常见的产品有腹腔镜、关节内窥镜、引流系统、牙科充填材料和皮肤钉等;第三种情况是与循环血液接触的医疗器械,常见的产品就是血管内导管、临时性起搏电极、氧合器、体外氧合器管路及附件,透析器等。
1.3 植入医疗器械
按照植入医疗器械的应用部位,又分为两种情况。第一种情况是主要与骨接触的医疗器械或与组织和组织液接触的医疗器械,与骨接触的常见的产品有矫形钉、矫形板和人工关节等,与组织和组织液接触的医疗器械常见产品主要有起搏器、植入性给药器械、人工肌腱、乳房植入物等;第二种情况是在心血管系统内主要与循环血液接触的医疗器械,常见的产品有起搏器电极、人工动静脉瘘管、心脏瓣膜、人工血管和心室辅助器械等。
2. 按接触时间分类,一般分为:短期接触(A)医疗器械、长期接触(B)医疗器械、持久接触(C)医疗器械、瞬时接触医疗器械和多种接触时间医疗器械。
2.1 短期接触(A)医疗器械
一次、多次或重复接触,累计时间在24h以内的医疗器械。
2.2 长期接触(B)医疗器械
一次、多次或重复接触,累计时间在24h以上30d以内的医疗器械。
2.3 持久接触(C)医疗器械
一次、多次或重复接触,累计时间超过30d以上的医疗器械。
2.4 瞬时接触医疗器械
某些与人体短期接触(A)的医疗器械非常快速/短暂接触人体(如使用时间小于1min的手术刀皮下注射针、毛细管),通常不需要生物相容性试验。然而,某些产品的材料,如涂层或润滑剂在医疗器械移除后可能会留在所接触的人体组织内,因此可能需要更详细的生物相容性评估。还宜考虑累积使用时间。
2.5 多种接触时间分类的医疗器械
如果一种材料或医疗器械兼属于一种以上的时间分类,应采用较严的试验和/或评价考虑。对于预期多次接触的医疗器械,对医疗器械分类应考虑潜在的累积作用和这些接触总的跨越时间。如果一种医疗器械预期在使用寿命期间发生变化,比如在原位发生聚合和/或降解,应分别对医疗器械的不同状态进行评价。例如,预期在原位发生聚合的可吸收胶,该医疗器械的不同状态就包括:原始组分、中间反应产物、完全聚合的材料和降解产物。
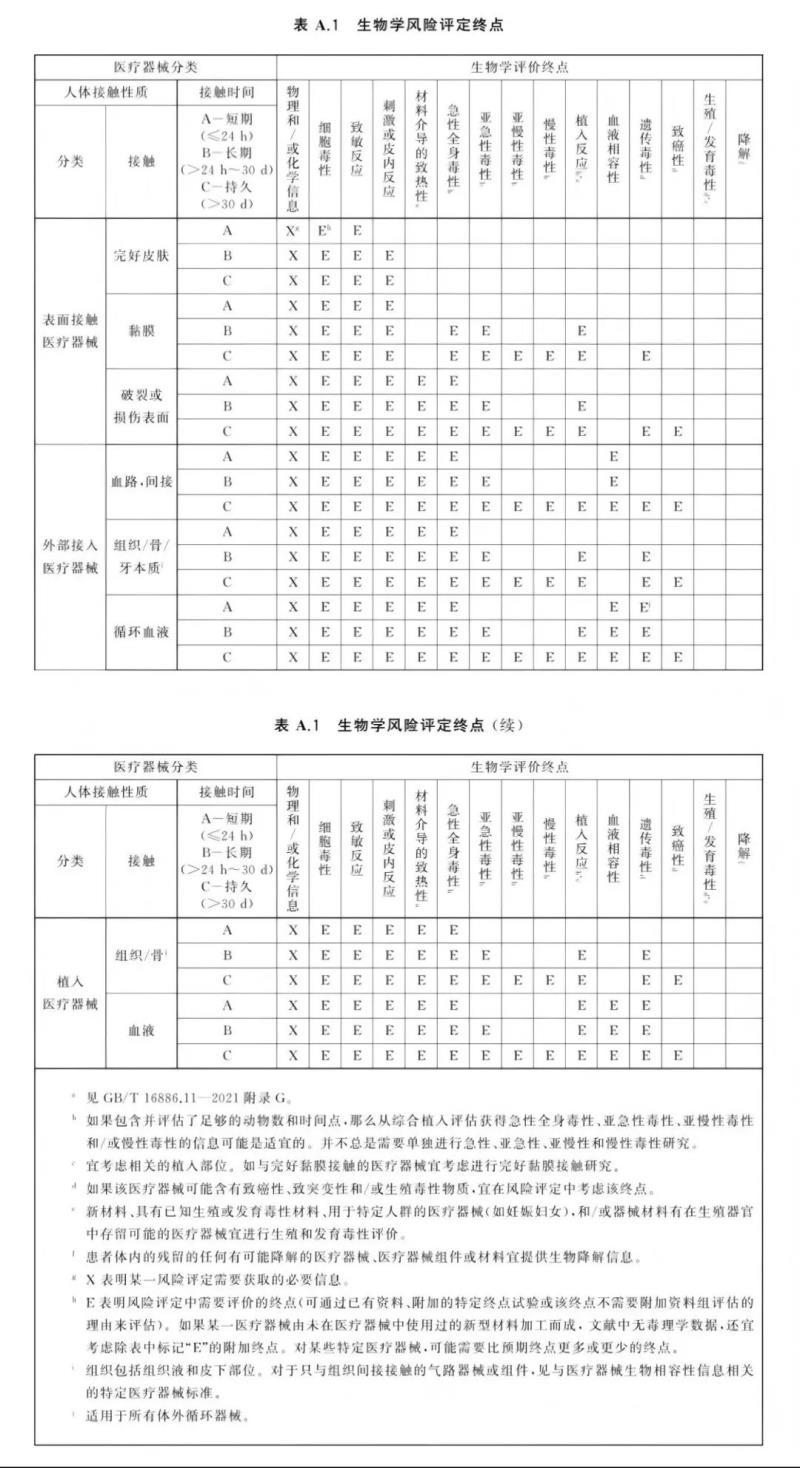
按照上述接触性质和接触时间2个分类原则确定了医疗器械类别之后,再根据标准GB/T 16886.1-2022的附录A表A.1给医疗器械找出相对应的生物相容性检验项目。
往期精彩推荐
医疗器械注册咨询认准金飞鹰
深圳:0755-86194173
广州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江苏:135-5494-7827
广西:188-2288-8311
海南:135-3810-3052
重庆:135-0283-7139


